När det gäller naturgas får du inte vara okänd med den, och numera kan inget hushåll laga utan den. Huvudkomponenten i naturgas är metan, som är en av de enklaste kolväteföreningarna. Att påskynda utvecklingen och användningen av metan är nyckeln till att förverkliga den gröna och hållbara utvecklingen av energi- och kemisk industri. Utöver dess direkta användning som bränsle kan metan också användas som en C1-resurs, det vill säga en molekyl som innehåller en kolatom och kan fortsätta att omvandlas för att framställa kemikalier med hög värde, såsom metanol, formulär syra och så vidare. Metan kan brännas i syre för att bilda vatten och koldioxid. Utan förbränning, är det möjligt att aktivera och konvertera kolvätebindningarna för metanmolekyler under milda förhållanden? Svaret är ja! Detta är reaktionen "helig gral" inom katalysområdet. Reaktioner förknippade med "heliga gral" är ofta extremt utmanande, eftersom de kan behöva genomföras under mycket hårda förhållanden, eller de kan behöva övervinna de inneboende svårigheterna med en kemisk reaktion, såsom aktivering av mycket stabila föreningar, låga utbyten och låg selektivitet. Dessa utmaningar gör det svårt att förverkliga dessa reaktioner, men om de framgångsrikt kan uppnås kommer de att leda till betydande genombrott i vetenskaplig forskning och industriella tillämpningar.

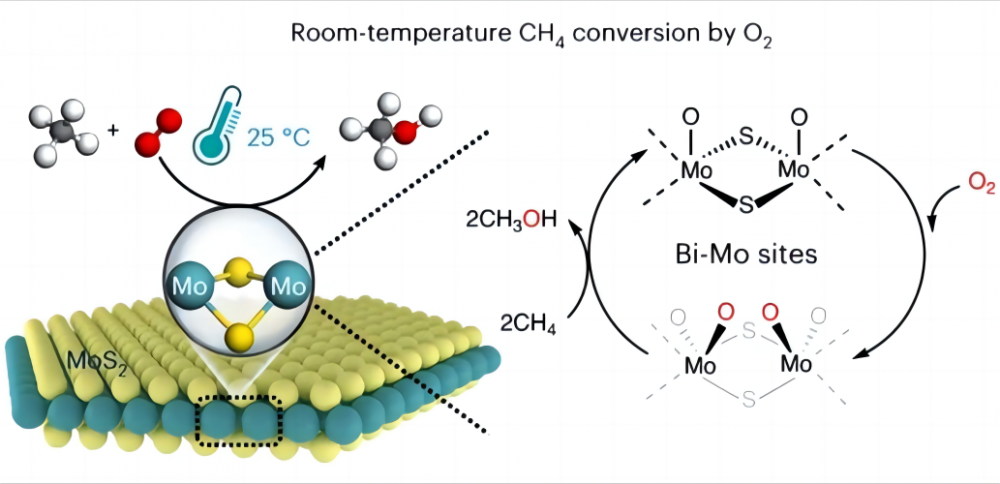
1.Challenges i omvandlingen av metan vid låga temperaturer Det är mycket svårt att konvertera metan direkt till andra användbara kemikalier med billigt syre vid låga temperaturer eller till och med rumstemperatur, varför är det? Låt oss titta på naturen av metan och syre. Den kemiska strukturen för metan innehåller fyra identiska kolvätebindningar (CH) som bildar en mycket symmetrisk ortotetraedral konfiguration, och varje CH3-H-bindning av metan har en bindningsenergi på upp till 435 kJ/mol. Vi kan tänka på CH -bindningen av metan som en särskilt stark vår. Denna vår är mycket stram och kräver mycket kraft att sträcka. I kemi är denna "kraft" den energi som krävs för att bryta CH -bindningen. Denna höga bindningsenergi gör Methanes CH -bindningar termodynamiskt stabila och mycket svåra att bryta ner eller reagera med under normala förhållanden. On the other hand, in chemical reactions, reactive groups are usually generated under polar interaction (polar interaction is the phenomenon that a molecule has one end positively charged and the other negatively charged), whereas the symmetric structure and nonpolar nature of the methane molecule prevents Det från att generera sådan polaritet (enligt molekylkonfigurationen har en molekyl med ett symmetriplan ingen polaritet) och kan inte tillhandahålla reaktiva grupper. Därför är aktivering och omvandling av metan mycket utmanande och kräver vanligtvis svåra förhållanden som höga temperaturer (600-1100 ° C) eller några "extremofiler" såsom superstarka syror och fria radikaler för att hjälpa till att aktivera metan. Därför ligger den största svårigheten att förverkliga lågtemperaturaktiveringen av metan och syre i hur man aktiverar CH-bindningen av metan, dvs hur man sträcker "fjädern" i CH-bindningen. 2. Mirakel av katalysator Forskare kom med en bra lösning på detta problem och valde att använda en katalysator för att hjälpa till att aktivera metan vid låga temperaturer (en katalysator är en kemikalie som inte förändras före eller efter en reaktion, men påskyndar reaktionen genom att förändra minsta mängd av energi som måste injiceras för att reaktionen ska äga rum). År 2023 rapporterade tidskriften Nature Catalysis om processen för att uppnå direkt omvandling av metan med syre till C1 -oxider (metanol (CH3OH), myrsyra (HCOOH) och metylenglykol (Hoch2OH) med användning av en specifik molybden -disulfid (MOS2) och Katalysator vid 25 ° C. En metanomvandling av 4,2% och nästan 100% C1 -syreen uppnåddes genom att förvandla metan och syre till värdefulla C1 -syresättningar under omgivande förhållanden. Denna MOS2 är den enda katalysator som hittills rapporterats som kan inse rumstemperaturomvandlingen av metan och syre. Allt beror på den unika geometri och elektroniska strukturen på MO -platsen på kanten av MOS2. Denna MO -plats har en hög aktiveringsaktivitet mot syre i en vattenhaltig miljö och bildar den magiska o = mo = o* -arten. Denna art gör kolhydrogenbindningen enklare att bryta och minska aktiveringsenergin i CH-bindningen av metan, vilket ökar metanens reaktivitet och därmed inser lågtemperaturaktivering av metan och syre. Denna upptäckt kommer att ge fler möjligheter för framtida energianvändning och miljöskydd, samt att ge oss en djupare förståelse för den fantastiska rollen som katalysatorer och hjälpmedel.
3. Betydande strategisk betydelse av lågtemperaturaktivering av metan Att inse den direkta katalytiska omvandlingen av metan och syre vid rumstemperatur och omvandla metan i naturgas till andra användbara kemikalier, kan förbättra användningshastigheten för naturgas kraftigt, minska avfallet och bättre skydda miljön och inse en hållbar utveckling av energi . För det andra, som en växthusgas, är metan bara för att koldioxid i dess bidrag till den globala uppvärmningen. Om metan kan omvandlas till andra ämnen, kan det hjälpa oss att minska utsläppet av luftföroreningar (t.ex. koloxider, kväveoxider, svaveloxider, kolväten och eterföreningar) och underlätta trycket av global uppvärmning.




